חדשות

תוכן עניינים |
טיפול בחולי מיאסטניה גרביס ע"י תרופה חדשה: Efgartigimod (Vyvgart)
למרות מגוון אפשרויות הטיפול, חלק מחולי מיאסטניה גרביס ממשיך לסבול מפגיעה בתפקוד היומיומי ומאיכות חיים ירודה. לפיכך, נותר צורך בטיפול ממוקד שנסבל היטב, שיכול לעזור לאוכלוסיית חולים רחבה.
מאת ד"ר אמיר דורי, מנהל מרפאת עצב-שריר והמעבדה לאיבחון מחלות עצבים היקפיים ושרירים, במרכז הרפואי שיבא, תל השומר.
מיאסטניה גרביס - רקע
מיאסטניה גרביס היא מחלה נדירה, כרונית, אוטו-אימונית המתווכת ע"י נוגדנים שמשבשים את ההפעלה של הממברנה הפוסט-סינפטית בצומת עצב-שריר[1]. התוצאה של זה היא חולשת שרירים שמחמירה לאחר פעילות, ולכן יכולה לפגוע בתפקוד. קבוצות שרירים שונות נפגעות במחלה והתסמינים העיקריים קשורים לפגיעה בתנועתיות העיניים והעפעפיים, בליעה, דיבור, כוח גפיים ותפקוד נשימתי[2].
בכ-15% מהמטופלים המחלה מוגדרת עינית בלבד ובכ-85% נפגעות קבוצות שרירים נוספים והמחלה מוגדרת כללית. בכ-85% מהחולים עם המחלה הכללית נמצאים נוגדני IgG עצמיים כנגד הקולטן לאצטילכולין (AChR) ולבלוטת התימוס (Thymus) יש תפקיד חשוב בייצור שלהם[3]. במיעוט החולים מופיעים נוגדנים כנגד חלבוני תפקוד ומבנה אחרים, כגון: MuSK ו-LRP4 או שלא מזוהים נוגדנים כלל (Seronegative)[4][5].
נוגדנים כנגד ה-AChR גורמים להתפתחות המחלה במספר מנגנונים מוכרים: חסימת יכולת ההפעלה של הקולטנים, הפחתה בביטוי הקולטנים עקב הגברת הפנמה ופירוק שלהם בתוך התאים (אינטרנליזציה ודגרדציה), והפעלת מערכת המשלים שגורמת לדלקת מקומית והורסת את מבנה הצומת. פעולות אלו מובילות לפגיעה בתפקוד וירידה בצפיפות של הקולטנים, לפגיעה בתמסורת העצבית אל השריר והפחתה ביכולת ההפעלה שלו[6][7][8][9].
שכיחות המחלה נעה בטווח של 40-250 מקרים למיליון בני אדם והיארעות בטווח של 4-12 מקרים חדשים למיליון איש לשנה [10]. היא יכולה להופיע בכל גיל, בנשים ובגברים, אך שכיחה יותר בנשים מתחת לגיל 50 (60-70% מהמקרים), ובגילאים מבוגרים יותר (מעל 50) שכיחה יותר בגברים (ביחס 2:1) [11].
הטיפול במיאסטניה גרביס השתנה מאוד במהלך השנים, וכעת יש מגוון טיפולים אפשריים שמותאמים למצב המחלה. תרופות שמעכבות את האנזים אצטילכולין אסטראז (AChE) מאפשרות זמינות גבוהה יותר של הטרנסמיטור אצטילכולין שמפעיל את הקולטן AChR ובכך משפרות מעט את הפעלת השריר ואת הכוח שנוצר. הטיפול אינו מנטרל את הנוגדנים או את הדלקת שנוצרת בגינם, על כן הוא אינו משנה את מהלך המחלה, אלא מהווה טיפול בסימפטומים בלבד. בהתאם לכך, השפעת הטיפול הסימפטומטי בעלת משמעות בעיקר כשהסימפטומים קלים, ומרוכזים בתנועות העיניים והעפעפיים. קורטיקוסטרואידים, בעיקר התרופה פרדניזון, משמשים באופן נרחב בטיפול במיאסטניה גרביס. הם בעלי מנגנון פעולה רחב היקף שמשפיע על מערכת החיסון במגוון שלבים, ועל כן מנטרלים את הדלקת שנוצרת בצומת עצב-שריר ומדכאים את התאים שיוצרים את המחלה בד"כ עם יעילות טובה מאוד. אבל, במידה ונדרש טיפול ארוך טווח עם מינונים גבוהים של סטרואידים, הם גורמים לתופעות לוואי משמעותיות כגון סוכרת, עלייה במשקל, יתר לחץ דם, אוסטאופורוזיס ופגיעה במערכות נוספות [9]. כשנחוץ טיפול ממושך, ניתן להוסיף לטיפול תרופות מדכאות חיסון שמאפשרות להפחית במידה ניכרת את מינון הסטרואידים הנחוץ.
במצבים חמורים עם סכנת חיים, במצבים בהם יש עמידות לטיפול או שלא ניתן להפחית את מינון הסטרואידים בשל חזרת סימפטומים יש לרוב צורך בטיפולים נוספים. אלה כוללים בעיקר את סינון הדם (פלזמפרזיס, Plasmapheresis) לשם סילוק כלל הנוגדנים, או בטיפול עם אימונוגלובולינים (Human Immunoglobulins) שלהם השפעה רחבה. את ייצור הנוגדנים הכללי ניתן להפחית ע"י התרופה Rituximab, שמחסלת את תאי ה-CD20 שמייצרים אותם, עם יעילות שונה בין הדיווחים בספרות, שהינה כנראה מייטבית אם ניתנת מוקדם [12]. גישה טיפולית נוספת לחולים שעמידים לטיפול או ממשיכים לסבול מתסמינים משמעותיים היא חסימת הפעלת מערכת המשלים, ובכך מניעת הרס הצומת עצב-שריר ושימור תיפקודו [13].
Efgartigimod
Efgartigimod היא תרופה חדשה בארסנל הטיפולי במיאסטניה גרביס, לחולים שלהם יש נוגדנים כנגד ה-AChR. התרופה ניתנת בעירוי לווריד, וגורמת לסילוק הנוגדנים מהדם, בדומה לתוצאה של פלזמפרזיס, אך ע"י שיפעול מנגנון פנימי.
מנגנון הפעולה של efgartigimod מבוסס על הפעלת קולטן נאונטלי שקושר את הקצה (Fc) של נוגדני IgG על כן קרוי Fc-neonatal Receptor(FcRn). הקשירה לקולטן זה מאפשרת מחזור ושימור של נוגדני IgG בדם, ובכך מאריכה את זמן מחצית החיים שלהם פי 4 לעומת אימונוגלובולינים אחרים כגון IgA או IgM[14]. המנגנון מנצל תופעה בה נוגדני IgG במחזור הדם "נבלעים" ע"י דופן תאי האנדותל בתהליך שקרוי אנדוציטוזיה שיוצרת כיס פנימי – אנדוזום. בתוך זה, נוגדני ה-IgG נקשרים לקולטני FcRn שבדופן האנדוזום[15] ובזכות הקישור הם ניצלים מפירוק (מדגרדציה ליזוזומלית) ומשוחררים אל מחוץ לתא, בחזרה למחזור הדם [16][17][18][19].
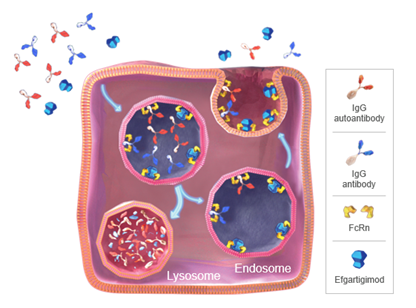
כפי שמתואר באיור מס' 1, התרופה efgartigimod דומה למקטע Fc של נוגדן IgG1 ועל כן נקשרת אל ה-FcRn בדומה לנוגדני IgG. אבל לעומתם, היא בעלת זיקה (אפיניות) מוגברת ל-FcRn, ולכן מתחרה באופן יעיל כנגד ה-IgG השלם על הקישור ל-FcRn. בשל כך, נוגדני IgG נותרים ללא קישור ל-FcRn, ולכן עוברים פירוק מוגבר במקום מיחזור [20].
במחקרי פאזה 1 ו-2, הטיפול עם efgartigimod הפחית באופן מובהק את רמות IgG על סוגיהם השונים בדם של מטופלים, מבלי להפחית רמות אימונוגלובולינים אחרים או רמות אלבומין בדם, שממוחזר אף הוא ע"י FcRn. ההפחתה ברמות IgG לוותה בשיפור קליני משמעותי וממושך בתסמיני המחלה ובפעולות היומיומיות שהמטופלים יכלו לבצע ([20][21].
המחקר הקליני שהוכיח את יעילות efgartigimod
זהו מחקר פאזה שלישית הקרוי ADAPT, פורסם בעיתון Lancet ב-2021 ותאר את הבטיחות והיעילות של efgartigimod בטיפול בחולי מיאסטניה גרביס כללית[22].
במחקר השתתפו 167 חולי מיאסטניה גרביס בוגרים (מעל גיל 18), עם או ללא נוגדנים ל-AChR (על כן AChR+ / AChR-). התקבלו למחקר חולים עם חומרת מחלה שדורגה לפי הקלסיפיקציה של ה-Myasthenia Gravis Foundation of Americaי(MGFA) ברמה של II-IV. דירוג זה מעיד כי לא מדובר היה בחולים עם מחלה שמוגבלת לחולשת שרירי עיניים בלבד, אלא כללית, אך ללא צורך בצנרור קנה. מידת הפגיעה התפקודית של החולים הוערכה ע"י מדד תפקוד יומיומי - Myasthenia Gravis Activities of Daily Livingי(MG-ADL) הגדול/שווה ל-5. דרגה זו העידה על פגיעה משמעותית בתפקוד. המשתתפים במחקר נדרשו לטיפול קבוע עם מינון יציב ע"י לפחות תרופה אחת מתוך מ-3 קבוצות התרופות המקובלות לטיפול במיאסטניה גרביס: מעכבי AChE, קורטיקוסטרואידים או מדכאי חיסון שאינם סטרואידים. הטיפול במחקר היה כתוספת (add-on) לטיפול הקבוע.
המשתתפים במחקר עברו רנדומיזציה ביחס 1:1 לקבלת תרופת המחקר - efgartigimod במינון של 10 מ"ג/ק"ג או פלצבו, שניתנו בעירוי אחת לשבוע במשך 4 שבועות (מחזור טיפול). כל המטופלים קיבלו את מחזור הטיפול הראשון ולאחר מכן בוצע מעקב שבועי בכדי לקבוע אם יש צורך במחזור טיפול נוסף לאחר 4 שבועות מסיום מחזור הטיפול הראשון. מחזור טיפולי נוסף אושר אם המטופל היה עם המשך נוכחות סימפטומטים חמורים או הראה תגובה לטיפול אך שנעצרה. מחזור טיפולי שני ניתן החל מ-8 שבועות לאחר התחלת המחזור הראשון, כלומר לפחות 5 שבועות אחר העירוי האחרון של המחזור הראשון.
התוצא הראשוני (primary outcome) של המחקר הוגדר כאחוז המטופלים (AChR+) בעלי תגובה קלינית משמעותית (MG-ADL Responders) במהלך מחזור הטיפול הראשון. הגדרת MG-ADL Responders: מטופל שהראה שיפור של לפחות 2 נקודות במדד MG-ADL, שהחל במהלך מחזור הטיפול הראשון (בתוך 4 שבועות מהעירוי הראשון) ושנמשך לפחות 4 שבועות ברציפות.
המאפיינים הקליניים והדמוגרפיים של המשתתפים במחקר (גיל, מין) היו דומים בין קבוצת הטיפול והפלצבו, הן באוכלוסייה הכללית והן במטופלים AChR+. הזמן הממוצע מאבחון המחלה ועד להשתתפות במחקר היה בין 9-10 שנים. חומרת המחלה בתחילת המחקר לפי ציוני ה-MG-ADL וה-Quantitative Myasthenia Gravis(QMG) היו 9 ו-16 בהתאמה, וזאת על אף שמרביתם (כ-80%) טופלו לפני המחקר בטיפול אימונוסופרסיבי המקובל (קורטיקוסטרואידים, מדכאי חיסון או שילוב שלהם).
ממצאי היעילות והבטיחות במחקר הראו כי efgartigimod עמד בתוצא הראשוני שנקבע, כאשר 68% מהמטופלים AChR+ הראו תגובה קלינית משמעותית לתרופה והוגדרו כ-MG-ADL Responders, לעומת 30% בלבד בפלצבו, הבדל שנמצא סטטיסטית מובהק (p<0.0001). efgartigimod עמד גם בתוצא השניוני שנקבע, כאשר 63% מהמטופלים AChR+ הראו תגובה קלינית משמעותית (ירידה של 3 נקודות ויותר) על פי מדד QMG והוגדרו כ-QMG Responders, לעומת 14% בפלצבו בלבד, הבדל שגם הוא נמצא מובהק סטטיסטית (p<0.0001). במהלך מחזור הטיפול הראשון, 40% מהמטופלים AChR+ השיגו שיפור קליני שהביא לביטוי תסמינים מינימלי (ניקוד של 0/1 על פי מדד MG-ADL), לעומת 11% בפלצבו. מבחינת משך התגובה, עבור 57% מהמטופלים AChR+ שהיו MG-ADL Responders במהלך מחזור הטיפול הראשון התגובה נמשכה 8 שבועות ויותר, ואילו עבור 34% מהם התגובה נמשכה 12 שבועות ויותר. במחזור הטיפול השני, אחוז המטופלים AChR+ שהיו MG-ADL Responders עמד על 71% לעומת 26% בקבוצת הפלצבו.
בדיקות המעבדה הראו ירידה מקסימלית של כ-60% ברמת הנוגדנים כנגד AChR וכלל נוגדני IgG לאחר הטיפול הרביעי של המחזור הראשון. ערכים אלה חזרו למצב הבסיסי לאחר 12 שבועות מתחילת הטיפול, כלומר 9 שבועות לאחר הטיפול האחרון של המחזור הראשון. ירידה דומה נצפתה בין הסוגים השונים של IgG. בכל מחזור טיפולי נצפתה ירידה דומה בנוגדנים כנגד AChR ובנוגדני ה-IgG ככלל, ללא ירידה ברמות אלבומין. פרופיל הבטיחות הראה כי מרבית תופעות הלוואי היו קלות-בינוניות בחומרתן והיו דומות בשכיחותן בין קבוצת הטיפול לפלצבו. תופעת הלוואי הנפוצה ביותר הייתה כאב ראש, עם שכיחות דומה בין הקבוצות. נצפתה עלייה בשכיחות זיהומי מערכת השתן ומערכת הנשימה העליונה, כ-10% בקבוצת הטיפול לעומת כ-5% בקבוצת הפלצבו, אך אותם זיהומים היו קלים-בינוניים בחומרתם. לא נצפו שינויים במדדים חיוניים של המטופלים, בדיקות לב או בדיקות דם.
ממצאי היעילות והבטיחות תחת טיפול ממושך
לאחר סיום מחקר ADAPT 151 מטופלים המשיכו לקבל את הטיפול במסגרת מחקר המשך, עם תווית גלויה, שנקרא ADAPT+[21]. מתוכם 145 מטופלים קיבלו מחזור טיפול אחד ויותר של efgartigimod. במהלך מחקר זה נצפתה ירידה עקבית ברמות IgG, על סוגיו השונים, הן בקבוצת המטופלים הכללית והן בקבוצת המטופלים AChR+. הירידה הגדולה ביותר נצפתה בשבוע 3. בנוסף, הטיפול עם efgartigimod הראה יעילות דומה על פי המדדים הקליניים השונים, גם במעקב ארוך טווח, כאשר ב-MG-ADL בוצעה אנליזה של 10 מחזורי הטיפול שהמטופלים קיבלו ואילו ב-QMG בוצעה אנליזה של 7 מחזורי הטיפול.
מרבית תופעות הלוואי במחקרי ה-ADAPT וה-ADAPT+ היו קלות עד בבינוניות בחומרתן, לרבות תגובות המשויכות לעירוי. במחקר ההמשך, 15.2% (22/145) מהמטופלים חלו ב-COVID-19 או סבלו מדלקת ריאות המשויכת ל-COVID-19, כאשר בשניים מהם התחלואה הוגדרה כחמורה. דווחו 5 מקרי מוות במהלך מחקר ה-ADAPT+, וכולם נמצאו על ידי החוקרים כבלתי קשורים לטיפול.
סוכם שפרופיל הבטיחות שנצפה במחקר ה-ADAPT+ היה דומה מאוד לזה שנצפה במחקר ה-ADAPT, וזאת על אף שהמחקר נערך בזמן מגיפת ה- COVID-19. ניתוח ממצאי מחקר ה-ADAPT+ מרמז על כך שטיפול ארוך טווח ב-efgartigimod הינו יעיל ומביא לשיפור משמעותי קליני, מתמיד וממושך, הן בתפקוד והן בכוח הפיזי של המטופלים. כמו כן, הטיפול נסבל היטב.
התכשיר קיבל אישור מה-FDA האמריקאי ומהרשות המקבילה ביפן בדצמבר 2021, ומהרשות האירופאית - EMA באוגוסט 2022.
בישראל הטיפול ניתן עד כה במסגרת טיפול חמלה ובמימון ביטוחים רפואיים פרטיים. בקרב המטופלים במרכז הרפואי שיבא לא נצפו תופעות לוואי פרט לכאב ראש קל במיקרה אחד, והרושם הכללי היה שהטיפול יעיל.
לסיכום, הטיפול בחולי מיאסטניה גרביס שלהם נוגדנים כנגד ה-AChR כרוך בשילוב של מספר תרופות. בחולים שממשיכים לסבול מפגיעה בתפקוד היומיומי בשל חולשת שרירים ניתן להוסיף טיפול עם efgartigimod. טיפול זה ניתן בעירוי מידי שבוע במשך 4 שבועות, ומביא לרוב לשיפור משמעותי בתפקוד והקלה בסימפטומים שנובעים מהמחלה. הטיפול יכול להינתן באופן מחזורי לאורך זמן ממושך בהתאם לצורך, והינו עם פרופיל בטיחותי טוב.
הערות
- התכשיר נמצא בתהליכי רישום בישראל. למידע נוסף, אנא פנו לעלון לרופא המאושר ב-FDA.
- המאמר בחסות חברת מדיסון ואינו מהווה תחליף לייעוץ רפואי.
ביבליוגרפיה
- ↑ Gilhus NE. Myasthenia gravis. N Engl J Med 2016;375(26):2570–81.
- ↑ Gilhus NE, Tzartos S, Evoli A, Palace J, Burns TM, Verschuuren JJGM. Myasthenia gravis. Nat Rev Dis Primers 2019; 5: 30.
- ↑ Verschuuren JJ, Huijbers MG, et al. Pathophysiology of myasthenia gravis with antibodies to the acetylcholine receptor, muscle-specific kinase and low-density lipoprotein receptor-related protein 4. Autoimmun Rev. 2013. 12 (9): 918-923.
- ↑ Gilhus NE, Verschuuren JJ. Myasthenia gravis: subgroup classification and therapeutic strategies. Lancet Neurol 2015; 14: 1023–36.
- ↑ Zisimopoulou P, Evangelakou P, Tzartos J, et al. A comprehensive analysis of the epidemiology and clinical characteristics of antiLRP4 in myasthenia J Autoimmun 2014; 52: 139–45.
- ↑ Cole RN, Ghazanfari N, Ngo ST, Gervásio OL, Reddel SW, Phillips WD. Patient autoantibodies deplete postsynaptic musclespecific kinase leading to disassembly of the ACh receptor scaffold and myasthenia gravis in mice. J Physiol 2010; 588: 3217–29.
- ↑ Drachman DB, Adams RN, Josifek LF, Self SG. Functional activities of autoantibodies to acetylcholine receptors and the clinical severity of myasthenia N Engl J Med 1982; 307: 769–75.
- ↑ Engel AG, Arahata K. The membrane attack complex of complement at the endplate in myasthenia gravis. Ann N Y Acad Sci 1987; 505: 326–32.
- ↑ 9.0 9.1 Skeie GO, Apostolski S, Evoli A, et al. Guidelines for treatment of autoimmune neuromuscular transmission disorders. Eur J Neurol 2010; 17: 893–902.
- ↑ Spillane J, Higham E, Kullmann DM. Myasthenia gravis. BMJ 2012; 345: e8497.
- ↑ Gilhus NE, Verschuuren JJ. Myasthenia gravis: subgroup classification and therapeutic strategies. Lancet Neurol 2015;14(10):1023–36.
- ↑ Piehl F, Eriksson-Dufva A, et al. Efficacy and Safety of Rituximab for New-Onset Generalized Myasthenia Gravis: The RINOMAX Randomized Clinical Trial. JAMA Neurol 2022; 79(11):1105-1112.
- ↑ Howard JF Jr. Myasthenia gravis: the role of complement at the neuromuscular junction. Ann N Y Acad Sci 2018; 1412: 113–28.
- ↑ Kuo TT, Baker K, Yoshida M, et al. Neonatal Fc receptor: from immunity to therapeutics. J Clin Immunol 2010; 30: 777–89.
- ↑ Jensen PF, Schoch A, Larraillet V, et al. A twopronged binding mechanism of IgG to the neonatal Fc receptor controls complex stability and IgG serum halflife. Mol Cell Proteomics 2017; 16: 451–56.
- ↑ Ghetie V, Hubbard JG, Kim JK, Tsen MF, Lee Y, Ward ES. Abnormally short serum halflives of IgG in beta 2microglobulin deficient mice. Eur J Immunol 1996; 26: 690–96.
- ↑ Junghans RP, Anderson CL. The protection receptor for IgG catabolism is the beta2microglobulincontaining neonatal intestinal transport receptor. Proc Natl Acad Sci USA 1996; 93: 5512–16.
- ↑ Roopenian DC, Akilesh S. FcRn: the neonatal Fc receptor comes of age. Nat Rev Immunol 2007; 7: 715–25.
- ↑ Ward ES, Zhou J, Ghetie V, Ober RJ. Evidence to support the cellular mechanism involved in serum IgG homeostasis in humans. Int Immunol 2003; 15: 187–95.
- ↑ 20.0 20.1 Ulrichts P, Guglietta A, Dreier T, et al. Neonatal Fc receptor antagonist efgartigimod safely and sustainably reduces IgGs in humans. J Clin Invest 2018; 128: 4372–86.
- ↑ 21.0 21.1 Howard JF Jr, Bril V, Burns TM, et al. Randomized phase 2 study of FcRn antagonist efgartigimod in generalized myasthenia gravis. Neurology 2019; 92: e2661–73.
- ↑ Howard JF Jr, Bril V, Vu T, et al. Safety, efficacy, and tolerability of efgartigimod in patients with generalized myasthenia gravis (ADAPT): a multicentre, randomized, placebo-controlled, phase 3 trial. Lancet Neurology 2021; 20: 526-36.
מקור:
27.02.2023